10年后,西北大學(xué)的楊維也進行了大鼠皮膚的冷凍干燥實驗。他首先重點研究了濃度、孵育時間、孵育溫度對大鼠皮膚凍干保護劑海藻糖負(fù)載量的影響。實驗結(jié)果表明,大鼠皮膚對海藻糖的載入量的優(yōu)化條件為:海藻糖濃度800mmo1/L,孵育溫度37℃,孵育時間為7h。之后,皮膚組織分別進行凍干和吹干。
(1)凍干 皮膚組織在37℃加載海藻糖,4℃加載DMSO,將負(fù)載了海藻糖和DMS0的皮膚塊放入凍存管內(nèi),凍存管放入程序凍存盒,置于-80℃冰箱冷凍。12h后將冷凍的皮膚組織連同凍存管轉(zhuǎn)入預(yù)冷的凍干機,去掉凍存管蓋子。冷凍干燥機運行狀態(tài)參數(shù)為:冷阱中溫度-45℃,冷阱上方溫度0℃左右,真空度10Pa,凍干時間設(shè)置30h。先將皮膚樣品置于冷阱中凍干24h,然后在冷阱上方凍干6h。先在冷阱中凍干是為了防止皮膚組織中固態(tài)的水分回融再結(jié)晶對組織產(chǎn)生冰晶損傷,組織中大部分游離水升華后轉(zhuǎn)冷阱上方凍干,此時溫度稍高可以進一步除去組織內(nèi)部水分。
(2)吹干 皮膚組織在37℃、800mmol/L海藻糖培養(yǎng)液中孵育7h加載海藻糖,負(fù)載了海藻糖的皮膚用濾紙拭去表面殘留液體,表皮朝下平展于玻璃培養(yǎng)皿中,培養(yǎng)皿敞口置于生物安全柜(打開送風(fēng)開關(guān))吹干。大鼠皮膚的吹干時間設(shè)置為20~30h可以將皮膚中水分去除較徹底,玻璃化狀態(tài)良好。
經(jīng)檢測得知,剛凍干皮膚活性比剛吹干皮膚活性高1/3,保存時間延長到28d,凍干組皮膚活性與剛吹干組相當(dāng)。凍干過程中,皮膚組織內(nèi)水分先在DMSO保護下逐漸凍結(jié),放入凍干機后固態(tài)水升華,由于海藻糖取代水分子的作用,干燥過程組織形態(tài)結(jié)構(gòu)和活性不會發(fā)生變化,但在吹干過程中皮膚組織內(nèi)水分由液態(tài)直接蒸發(fā),原來包繞在細(xì)胞外的水膜以及和蛋白質(zhì)等生物大分子結(jié)合的水分子可能還未完全被海藻糖取代就已蒸發(fā)。上述原因可能導(dǎo)致未保存的凍干皮膚活性高于吹干皮膚。干燥保存的皮膚活性開始降低速率較快,降到一定程度后降低速率減慢,所以保存一周后凍干組和吹干組皮膚活性沒有統(tǒng)計學(xué)差異。
干燥保存的皮膚置于飽和濕度的恒溫培養(yǎng)箱37℃預(yù)水化15min后,皮膚依次用含800mmol/L和400mmol/L海藻糖的DMEM培養(yǎng)液室溫下孵育15min,用不含海藻糖的無血清DMEM培養(yǎng)液漂洗3次以上,清除皮膚組織中殘留的DMSO和海藻糖,最后轉(zhuǎn)入無海藻糖的DMEM培養(yǎng)液中孵育2h,進行形態(tài)觀察。如圖5-10所示。
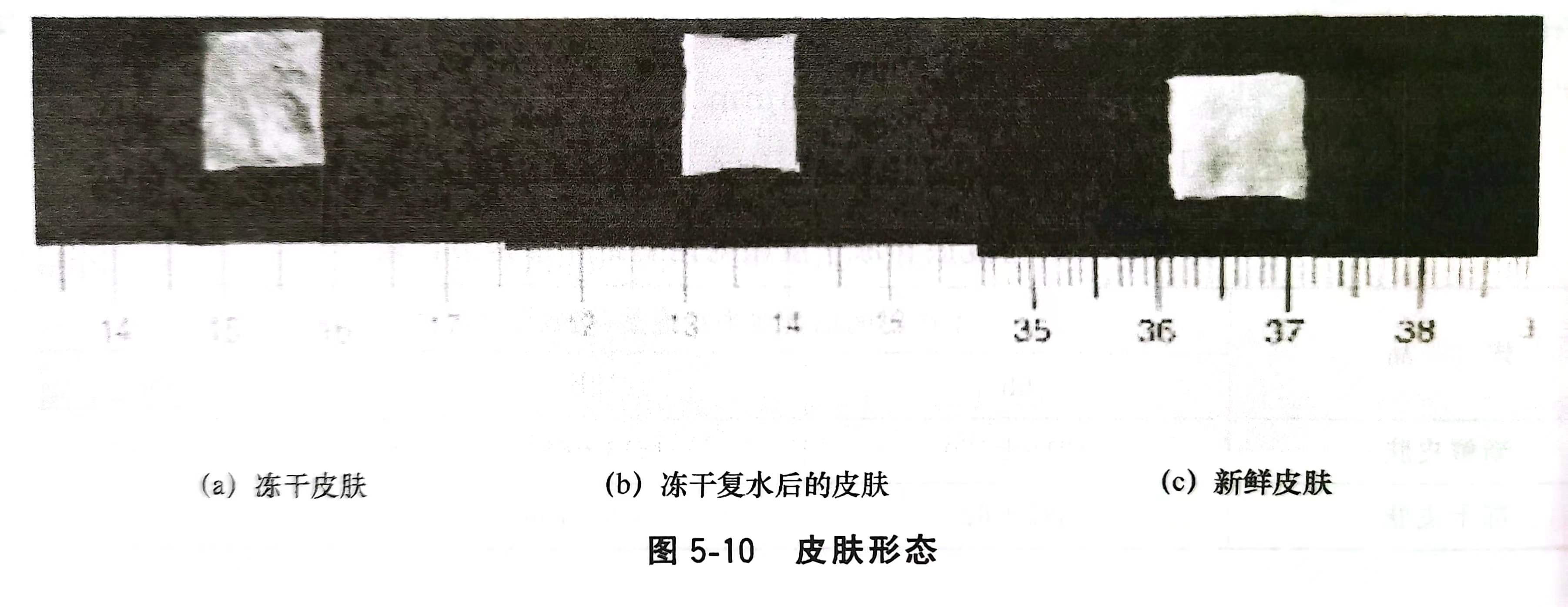
凍干皮膚玻璃化狀態(tài)良好,呈半透明狀。復(fù)水后能夠恢復(fù)到新鮮皮膚的大小和色澤。凍干皮膚角質(zhì)層局部受損,而組織結(jié)構(gòu)和細(xì)胞形態(tài)與新鮮皮膚組織沒有差異。將凍干后復(fù)水的皮膚移植回自體大鼠,可存活13d。
自體移植后凍干組皮膚存活時間較吹干組長,可能是由于吹干過程對皮膚組織產(chǎn)生的損傷較大。凍干組皮膚在6d皮下出現(xiàn)血紅色區(qū)域可能是自體動物在移植皮下發(fā)生血管化,但后來有兩處變成暗紅色,而其他區(qū)域血紅色減弱消失可能是血管化失敗,而吹干組未出現(xiàn)血紅色,可能根本就沒有發(fā)生血管化。
通過HE染色和透射電鏡對比分析新鮮皮膚和干燥皮膚組織結(jié)構(gòu)和細(xì)胞結(jié)構(gòu)。HE染色結(jié)果顯示干燥保存過程沒有明顯改變皮膚組織結(jié)構(gòu),也未影響皮膚組織的結(jié)構(gòu)完整性。透射電鏡結(jié)果說明干燥皮膚具有與新鮮皮膚無差別的細(xì)胞結(jié)構(gòu)和胞外膠原結(jié)構(gòu),同時可觀察到干燥皮膚細(xì)胞中結(jié)構(gòu)正常的線粒體和平滑的核膜等細(xì)胞器。結(jié)構(gòu)學(xué)觀察結(jié)果證明干燥保存未對皮膚組織結(jié)構(gòu)和細(xì)胞結(jié)構(gòu)產(chǎn)生明顯影響。
通過熒光標(biāo)記和MTT活性分析研究干燥過程對皮膚活性影響。熒光標(biāo)記結(jié)果表明,除毛囊處明顯受損外凍干皮膚組織大部分區(qū)域在水化后能恢復(fù)活性。MTT活性分析結(jié)果顯示凍干和吹干皮膚仍能分別保持58%和48%的活性。
