理想的角膜保存方法要滿足技術簡單、最大限度地保持角膜組織的活性、保持生理狀態下角膜厚度和結構、有利于手術操作等要求。現有的角膜保存技術中,除了最有代表性的4℃濕房短期保存法外,還有受者血清保存法、器官培養保存法、甘油冷凍保存法、深低溫冷凍保存法和無水氯化鈣干燥保存法,這些方法都沒能滿足上述理想保存方法的要求。角膜冷凍真空干燥的目的是保持其活性,便于較長時間的貯存,使需求者能及時得到活性角膜,以便再植。
5.5.1 眼角膜的凍干工藝流程
凍干角膜保持活性的關鍵是凍干工藝,角膜的凍干工藝是一個復雜的過程,如圖5-12所示。影響凍干效果的因素很多,如保護劑的配制、角膜的冷平衡、梯度降溫、凍干室內壓力變化、溫度變化,凍干角膜復水等。東北大學的王德喜對角膜的凍干進行了系列研究。研究中使用的是中國醫科大學臨床醫院動物室提供的大耳白家兔,體重為2~3kg。
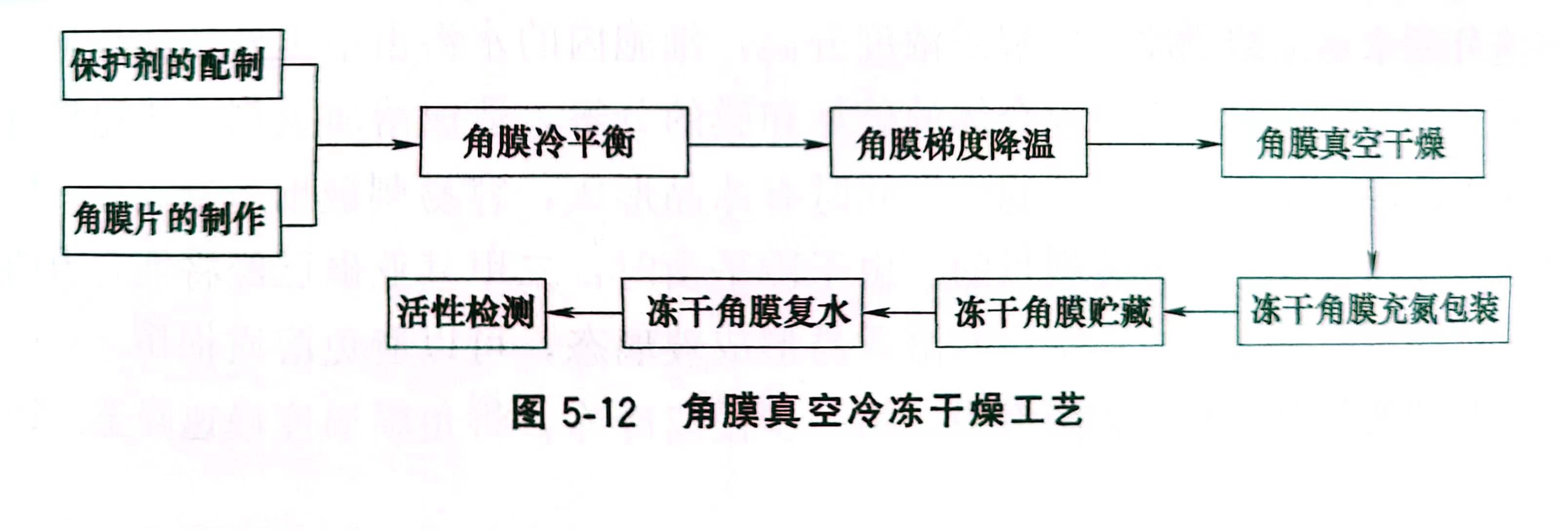
5.5.2 眼角膜凍結過程中的冷平衡
角膜在梯度降溫過程中,要經受-150℃以下的低溫損傷,在干燥過程中,要經受干燥應力的損傷,在沒有保護劑保護情況下,經歷如此損傷,角膜細胞很難保持活性。合理的選擇和配制保護劑對角膜的保存至關重要。實驗研究表明角膜由蔗糖、二甲基亞砜(DMSO)、20%安普萊士(人血白蛋白)作為保護劑,凍干效果良好。
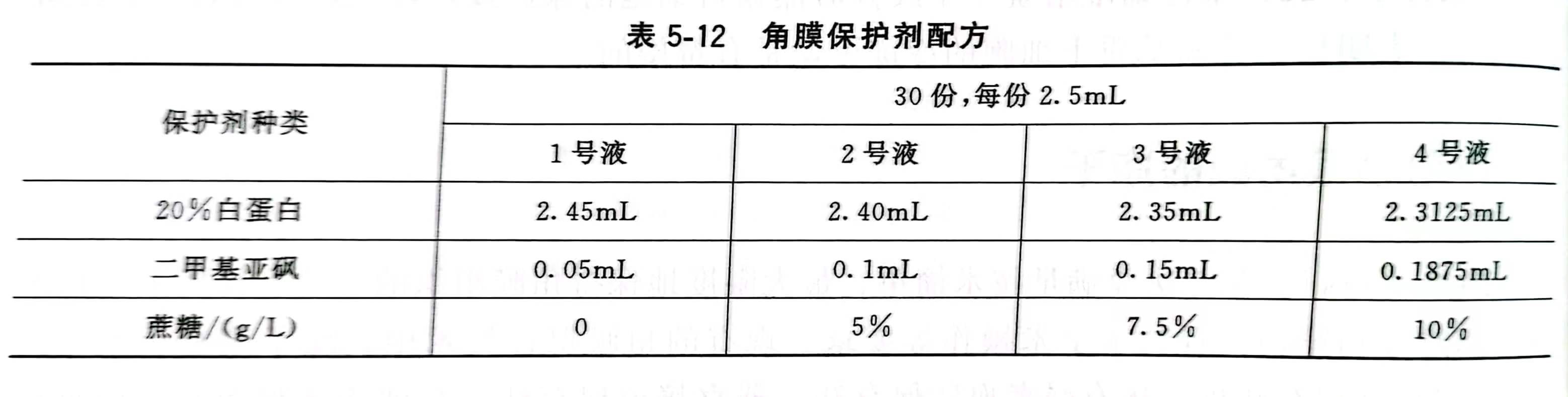
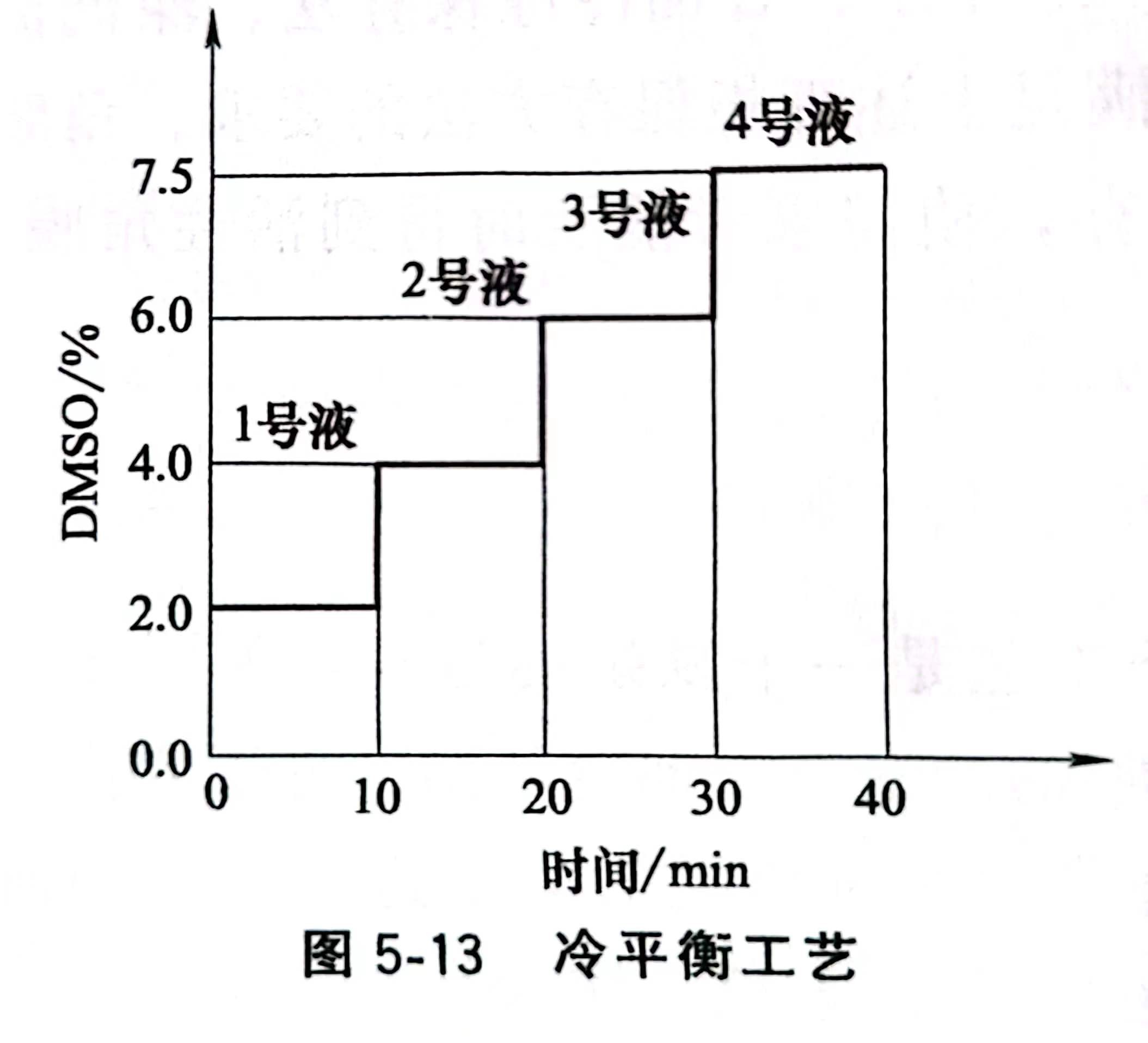
為了防止角膜在凍結過程中損傷,還要對角膜進行冷平衡處理。冷平衡保護劑的具體配比見表5-12。具體操作過程:將無菌的角膜片先放入1號液,移入4℃冰箱冷平衡10min,然后用無菌鑷子夾住鞏膜邊,將其移人2號液平衡10min,依次在3號液、4號液中各平衡10min。冷平衡工藝如圖5-13所示。在冷平衡過程中,保護劑中的DMSO通過角膜的細胞膜進入到細胞中,置換出其中部分水分,在達到動態平衡前,保護劑中DMSO濃度要高于細胞中DMSO濃度。角膜依次在不同濃度的保護劑中進行冷平衡,這樣角膜中的水分就會不停地與保護劑中的DMSO進行置換,經過一段時間的傳質,細胞中的水分將大量減少。由于細胞內水分溢出速度與DMSO的濃度有關,為防止細胞內水分溢出速度過快造成細胞的損傷,使角膜細胞有個適應過程,角膜冷平衡采取逐步遞增DMSO濃度進行平衡。冷平衡處理后兔角膜內皮細胞經聯合染色檢測,結果與新鮮角膜無區別,說明冷平衡對角膜內皮細胞的活性無損傷,該冷平衡工藝可行。
待角膜在4號液平衡結束后,立即取出放入磨口玻璃瓶里,在降溫儀中進行梯度降溫。梯度降溫目的是使細胞內的溶液凍結成玻璃態,以使角膜迅速越過對細胞凍傷最嚴重溫度區(-30~-60℃)時,細胞不受傷害。采用兩步法進行梯度降溫,第一步角膜距液氮面9cm,停留l0min,使角膜內部溫度穩定在-16~-20℃范圍內,此階段角膜的降溫速率為2~2.4℃/min;第二步角膜距液氮面1.5cm,停留10min,使角膜內部溫度穩定在-130~-150℃范圍內,此階段角膜的降溫速率為11~14℃/min。慢速降溫時,細胞外的水易凍結成冰,電解質濃度升高,細胞內的水滲出細胞外,使細胞暴露在高濃度的溶質中,導致細胞膜蛋白復合體的破壞和膜的分解,造成溶質損傷。快速降溫時,細胞內的水來不及滲出便結成冰,細胞內外同時有冰晶形成,容易刺破細胞造成機械損傷。這樣必須快速慢速相結合,方可達到目的。由于冷平衡時,二甲基亞砜已經將細胞內的水分多數置換出去,在緩慢降溫時,細胞內的溶質易形成玻璃態,可以避免溶質損傷。故可以先慢速降溫,然后快速降溫。兩步法降溫中,第一步慢速冷凍,將角膜溫度慢速降至-20℃,可以避免過快冷凍時角膜內冰晶形成所造成的損傷和過慢冷凍時細胞置于高濃度溶液下時間過長所造成的溶液損傷。第二步快速冷凍,角膜以很快的降溫速率降至-130℃以下,細胞內未凍溶液實現了非晶態固化,使細胞少受或不受損傷。
